CCR 4抗體有望治療淋巴瘤 突破性療法獲認定
編輯:香港特區腫瘤中心 來源:網络 發佈時間:2017-08-30
近日,位於東京的Kyowa Hakko Kirin公司宣佈,美國FDA已授予其在研新藥mogamulizumab突破性療法認定。這是一款針對兩種罕見的非霍奇金淋巴瘤:蕈樣黴菌病(Mycosis Fungoides,MF)和塞澤裡綜合征(Sézary Syndrome,SS)的療法,用於已接受過至少一次系統療法的成人患者。這款新藥的突破性療法認定,也意味著罹患這兩種疾病的患者,有望迎來新的治療轉機。
在非霍奇金淋巴瘤的多種類型中,有一種亞型叫做皮膚T細胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)。其中,MF與SS是這種疾病最為常見的兩種類型。患者的皮膚上會有標誌性的惡性T淋巴細胞出現。隨著病情的推移,這種疾病最終可能會影響到皮膚、血液、淋巴結、以及臟器。
本次獲得突破性療法認定的mogamulizumab是一款人源化的單克隆抗體,能直接靶向CCR4蛋白。CCR4蛋白是在惡性血液疾病患者體內的淋巴細胞表面頻繁表達的一種蛋白,它也同樣表達于CTCL患者體內。通過靶向CCR4,新藥開發人員希望能增強抗體依賴的細胞毒性,對惡性血液疾病進行治療。先前,它已在日本獲批上市。
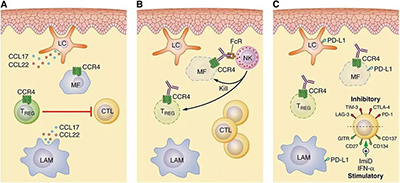
▲CCR4是皮膚T細胞淋巴瘤的治療靶點
在一項名為MAVORIC的公開標籤、多中心、隨機化的3期臨床試驗中,研究人員評估了mogamulizumab與化療藥物伏立諾他(vorinostat)在CTCL患者中的治療效果。這項研究在美國、歐洲、日本、澳大利亞招募了372名患者,這也讓它成為了史上規模最大的CTCL隨機臨床試驗。今年4月,Kyowa Hakko Kirin宣佈這項試驗取得了積極成果,在無進展生存期(PFS)的評估上抵達了主要臨床終點,具體資料將于未來的醫學會議上公開。基於這項試驗的出色結果,美國FDA決定授予mogamulizumab突破性療法認定。
“我們對mogamulizumab獲得如此有價值的認定感到非常激動!” Kyowa Hakko Kirin的執行官、副總裁、兼研究開發本部長佐藤光男(Mitsuo Satoh)博士說:“我們將繼續確保為全球罹患這種疾病的患者提供這款抗體。”
我們希望這款新藥能夠研發順利,造福廣大患者!

