美國FDA批准卵巢癌新款維持療法
編輯:香港特區腫瘤中心 來源:藥明康得 發佈時間:2017-08-21
2017年8月18日,美國FDA宣佈批准阿斯利康(AstraZeneca)的Lynparza(olaparib)片劑,用於復發性上皮卵巢癌、輸卵管癌、或原發性腹膜癌成人患者的維持治療。這些患者在先前接受鉑類化療後,正處於完全或部分緩解期。
卵巢癌是女性癌症患者最常見的死因之一。在帶有BRCA突變等特定遺傳性基因異常的情況下,女性發生卵巢癌的風險會顯著增加。由阿斯利康研發的olaparib是一款口服聚ADP核糖聚合酶(PARP)抑制劑,可以利用腫瘤DNA損傷反應(DDR)通路缺陷來殺傷癌細胞。2014年,olaparib膠囊獲得了美國FDA的加速批准,治療帶有BRCA基因突變的晚期卵巢癌患者。
在兩項隨機、設置安慰劑對照的雙盲、多中心臨床試驗中,研究人員進一步評估了這款藥物作為維持療法的可行性。在第一項名為SOLO-2的臨床試驗裡,研究人員招募了295名復發性卵巢癌、輸卵管癌、或是原發性腹膜癌患者,她們都帶有gBRCA突變,且正處於鉑類化療後的緩解期。研究發現,接受olaparib治療(300mg,每日口服兩次)的患者,無進展生存期(PFS)為19.1個月,相較對照組的患者(5.5個月)得到了顯著延長。
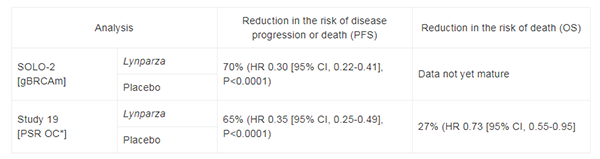
在另一項代碼為NCT00753545的臨床試驗裡,研究人員招募了265名患者,她們的BRCA突變狀況未納入考量。研究發現,服用olaparib(400mg,每日口服兩次)的患者,中位PFS為8.4個月,也顯著超過了對照組(4.8個月)。基於這兩項試驗結果,美國FDA批准了olaparib的片劑,作為這些適應症的維持療法。值得注意的是,olaparib片劑與olaparib膠囊並不能通用。
“醫生們在Lynparza的使用上已經有了快3年的經驗。今天我們很高興帶來這一重要藥物的新製劑形式,造福更廣大的婦女群體,”阿斯利康全球醫藥開發執行副總裁兼首席醫學官Sean Bohen博士說道:“今日的批准驗證了Lynparza背後10多年的辛勤研究。這款全球首個PARP抑制劑能讓腫瘤學家在治療選擇上有更大的靈活性。基於最近與默沙東(MSD)的合作,我們將進一步為患者帶來更多治療方案。”

