PD-L1免疫药物Imfinzi获批用于Ⅲ期非小细胞肺癌(NSCLC)治疗
编辑:香港特区肿瘤中心 来源:香港特区肿瘤中心 发布时间:2018-02-26
2018农历春节,美国FDA以一种特殊的方式恭贺新禧,尤其是对于肺癌患者来说,更是难得的喜事。阿斯利康(AstraZeneca)的PD-L1抑制剂Imfinzi(durvalumab)获美国FDA批准用于治疗无法手术切除、但病情在现有放化疗的治疗下没有出现进展的Ⅲ期非小细胞肺癌(NSCLC)患者。这是针对此类患者群体中第一个被批准用于降低放化疗后癌症进展风险的治疗方案。

肺癌是我国发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一。近50年来许多国家都报道肺癌的发病率和死亡率均明显增高,男性肺癌发病率和死亡率均占所有恶性肿瘤的第一位,女性发病率占第二位,死亡率占第二位。
其中非小细胞肺癌占所有肺癌的80%以上。对于手术无法切除的NSCLC,培美曲赛+卡铂+贝伐单抗成为肺腺癌类型患者的标准一线化疗,精准放疗的优化对部分患者也可以达到与手术比肩的效果。但如果此类疾病抵达Ⅲ期,就意味着肿瘤已经扩散到了附近的淋巴结,或是肺部附近的其他部位。这些患者的预后并不乐观,病情随时有恶化的风险。
此次PD-L1免疫药物Imfinzi获批用于Ⅲ期不可切除的非小细胞肺癌治疗方案,是基于一项713名Ⅲ期NSCLC患者参加的PACIFIC临床试验。与安慰剂对照组相比,Durvalumab治疗组使中位无进展生存期(PFS)提高了11.2个月(治疗组16.8:对照组5.6个月),风险降低48%,而与PD-L1状态无关。12个月PFS率治疗组为55.9%,而对照组为35.3%,18个月PFS率治疗组为44.2%,而对照组为27.0%。
基于这些公开的良好数据,美国FDA批准用于此类NSCLC患者,用于降低放化疗后癌症进展的风险。值得一提的是,这良好数据也曾让Imfinzi在该适应症上获得过突破性疗法认定与优先审评资格。此外,另一项关键数据总生存期(OS)正在统计中,将在未来公布。
“针对罹患Ⅲ期NSCLC、肿瘤无法切除且在放化疗后没有进展的患者,这是首款用于降低他们癌症进展风险的疗法,”FDA药物评估与研究中心血液学和肿瘤学产品办公室代理主任兼FDA肿瘤卓越中心主任RichardPazdur博士说道:“对于无法切除的Ⅲ期NSCLC患者,目前只有通过放化疗来预防肿瘤进展。尽管少量患者可能得到很好的治疗,但随时可能出现进展或转移。现在,患者们有了一款全新的获批疗法,能在放化疗后,更长时间地防止癌症出现进展。”
我们祝贺阿斯利康的这款新药获批扩大适应症,也期待它能为广大肺癌患者带来福音。
关于Durvalumab
作为一种针对PD-L1蛋白的单克隆抗体,Durvalumab能够结合肿瘤表面表达的PD-L1蛋白,抑制它们与T细胞表面的PD-1蛋白结合。因此,肿瘤细胞就无法利用PD-L1/PD-1途径来逃避免疫系统的追杀激活免疫系统杀伤肿瘤的效果。
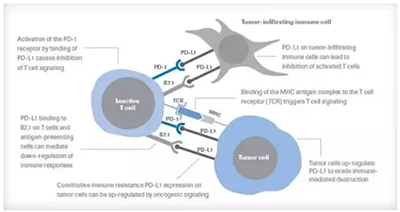
▲PD-L1/PD-1通路原理介绍
更让人惊喜的是,Durvalumab的副作用更小,最常见不良反应包括:疲劳、肌肉骨骼痛、便秘、食欲下降、恶心、外周性水肿和尿路感染,均为患者可以承受范围。因此,对于PD-L1表达的肿瘤患者,不失为一种好的选择。
Durvalumab效果究竟有多好
Durvalumab获美国FDA加速批准,是基于在一项有182名患者参与的临床试验中,Durvalumab的疗效得到确认基础上的。182名罹患晚期或转移性尿路上皮癌的患者先前接受了铂类化疗,但病情依旧出现了进展。临床实验中,每两周,这些患者接受10mg/kg Durvalumab静脉滴注。

独立的评审小组发现,患者的客观缓解率达到了17%。而在PD-L1高度表达的95名患者中,客观缓解率更是达到了26.3%。这对相当不乐观的晚期尿路上皮癌患者来说实在是太惊喜了!
更多关于Durvalumab的临床试验正在进行
除了获批于尿路上皮癌和Ⅲ非小细胞肺癌的治疗,PD-L1抗体Durvalumab更多的临床试验正在进行中,我们期待Durvalumab能获批用于头颈癌、胃癌、肝癌和血液肿瘤等疾病的治疗。

