重磅:史上首个诺华CAR-T细胞药物获FDA批准上市
编辑:香港特区肿瘤中心 来源:u. s. food & drug 发布时间:2017-08-31
2017年8月30日,医药行业迎来一条重磅新闻,诺华的基因治疗方法CAR-T细胞药物 Kymriah(tisagenlecleucel,CTL-019)被美国FDA批准上市,用于治疗儿童和年轻成人(2~25岁)的急性淋巴细胞白血病(ALL)。这是医学史上首款批准的CAR-T疗法,也是在美国境内,首次获批的基因疗法。诺华将Kymriah的价格定为治疗一次47.5万美元。
急性淋巴细胞白血病(ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病。原始细胞可在骨髓聚集并抑制正常造血功能,造成周边血管、骨髓、全身淋巴结、脾脏与肝脏的浸润,并在这些部位继续生长和分化。它们可以刺激脑脊髓膜,导致炎症(脑膜炎),贫血,肝脏和肾脏衰竭以及其他器官损害。ALL可发生于任何年龄,它是儿童最常见的恶性肿瘤,占15岁以下儿童所有恶性肿瘤的25%。ALL最常见于2~5岁之间的幼儿。对于成人来说,45岁以上更为多见。
近日获批的 Kymriah正是一款为这些患者带来福音的突破性治疗方法。CAR-T疗法(Chimeric Antigen Receptor T-Cell immunotherapy)全称嵌合抗原受体T细胞免疫疗法,其原理是将病人体内取得的T细胞,用基因工程的方法经激活、转染、修饰、扩增后,重新注射到病人体内,通过激发人体自身的免疫系统来消灭肿瘤。由于CAR-T克服了主要组织相容性复合体(MHC)的限制性,可更有效的杀伤抗原特异性的肿瘤细胞,减少了由于肿瘤降低MHC分子表达而造成的免疫逃逸,同时具备抗原抗体结合特异性好、亲和力高的优势。此外,由于打破病人对于MHC的限制后,CAR改造的T细胞相对于天然T细胞表面受体TCR能治别更广泛的目标。
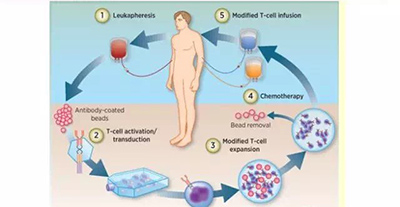
CAR-T细胞治疗具体来看主要分为5个步骤:
1. 从癌症患者外周血中分离出T细胞;
2. T细胞激活,利用基因工程将能特意识别肿瘤细胞的CAR结构转入T细胞;
3. 体外培养,大量扩增CAR-T细胞至治疗所需剂量,一般为十亿至百亿级别;
4. 化疗清淋预处理;
5. 回输CAR-T细胞,观察疗效病严密监测不良反应。
Kymriah的安全性与疗效在一个多中心的临床试验中得到了验证。这个临床试验招募了63名罹患难治性或复发性B细胞前体ALL的儿童和青年。在治疗的3个月内,CAR-T疗法带来的总体缓解率达到了83%。但同时,使用Kymriah有潜在的严重副作用,可能会产生细胞因子释放综合症(CRS)、神经毒性、脱靶效应等毒副作用。CRS和神经系统事件都可能危及生命。Kymriah的其他严重副作用还包括严重感染、低血压、急性肾损伤,大多数症状出现在输入Kymriah后1-22天。
同时,FDA扩大了Actemra(托西珠单抗)的批准,以治疗2岁以上患者因CAR-T细胞诱导的严重或危及生命的CRS副反应。在用CAR-T细胞治疗的患者的临床试验中,69%的患者CRS在一个或两个剂量的Actemra后两周内完全消除。
现任美国FDA局长的Scott Gottlieb博士说道:“基因和细胞疗法等创新科技具有变革医学的潜力,也能让我们在棘手疾病的治疗上迎来转折点,让我们有望治疗,甚至是治愈这些疾病。FDA致力于帮助加速有望拯救生命的革命性疗法的开发于审评。”
“5年前,我们开始与宾夕法尼亚大学(Universityof Pennsylvania)合作,投资并进一步开发我们认为足以改变癌症治疗范式的免疫细胞疗法。今日Kymriah的获批,也再次体现我了我们改变癌症治疗的承诺”诺华首席执行官Joseph Jimenez先生评论到。
作为肿瘤免疫治疗的主要手段之一,CAR-T细胞治疗在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出惊艳的治疗效果,2017年可谓是CAR-T疗法的元年,我们见证了历史上首款CAR-T疗法药物的问世,一个波澜壮阔的细胞疗法时代已经来临,我们期待为那些原本无药可治的患者,带去全新的生命曙光。

